Durante la conferencia mañanera del presidente de México desde Palacio Nacional, el pasado miércoles 3 de mayo, la directora general del ahora Consejo Nacional de Humanidades, Ciencias y Tecnologías (Conahcyt), María Elena Álvarez-Buylla, anunció (una vez más) a la sociedad mexicana que ya había vacuna “Patria”.
Pero esto no ocurrirá, al menos durante 2023, ya que el ensayo clínico de la candidata a vacuna titulado Estudio Fase II-III de la vacuna AVX/COVID-12 contra la COVID-19 aplicada como refuerzo, se completará hasta el 30 de septiembre de 2023 y requerirá varios meses más para que los resultados sean publicados en una revista científica, tal y como se establece en las normas nacionales e internacionales.
De acuerdo con la información publicada en la base datos ClinicalTrials.gov de la Biblioteca Nacional de Medicina de Estados Unidos –que registra más de 449 mil estudios clínicos relacionados con la enfermedad por el coronavirus en 221 países–, el ensayo clínico de “Patria” Fase II-III se está llevando a cabo con un número muy reducido de personas: solo 3 mil sujetos sanos (consultar en https://clinicaltrials.gov/ct2/show/NCT05710783).
Sin embargo, a diferencia de las otras 183 vacunas ya terminadas y en experimentación clínica aglutinadas en todo el mundo por la OMS, el número de personas en las que se está probando la candidata a “vacuna mexicana”, es muy limitado (consultar en: https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines).
A esta limitante se suma el hecho de que “Patria” tendrá que enfrentar las regulaciones prepandémicas debido al fin de la emergencia sanitaria decretado por el gobierno mexicano el pasado 9 de mayo.
Con el decreto publicado en el Diario Oficial de la Federación “se terminan todas las acciones extraordinarias en materia de salubridad general” que tuvieron por objeto “prevenir, controlar y mitigar la enfermedad causada por el virus SARS-CoV-2”, indica el documento, lo que incluye el fin de la aprobación de emergencia de vacunas contra la COVID-19 (consultar en https://dof.gob.mx/nota_detalle.php?codigo=5688265&fecha=09/05/2023#gsc.tab=0).
Esto implica que la vacuna tendrá que probarse en más ensayos clínicos y con un mayor número de individuos, los cuales deben incorporar, por un lado, pruebas con personas que padecen diversas comorbilidades y, por otro, grupos de diversas edades y sexos. Lo mismo ocurrirá a nivel internacional si es que se quiere tener la recomendación de la OMS.
En ensayo clínico fase II-III de la candidata a vacuna “patria” se completará hasta el 30 de septiembre de 2023 y requerirá varios meses más para que los resultados sean publicados en una revista científica.
Resultados de la Fase l
Los resultados del primer ensayo clínico de Fase I de la candidata a vacuna “Patria” se publicaron apenas el pasado 10 de mayo de 2023, en una de las revistas electrónicas del grupo Springer Nature llamada NPJ Vaccines, que se publica en línea y es de acceso abierto.
El artículo titulado Resultados provisionales de seguridad e inmunogenicidad de una vacuna COVID-19 basada en NDV ensayo fase I en México, cuyo autor principal es el investigador Samuel Ponce de León, del Programa Universitario de Investigación en Salud de la Facultad de Medicina de la UNAM, indica que la vacuna se probó entre 142 voluntarios, administrada por dos dosis, una vía intramuscular o intranasal seguida de otra dosis intramuscular.
En el artículo se indica que en 91 de las personas participantes “se encontró que la vacuna era segura y que las dosis más altas probadas eran inmunogénicas”, es decir, que era eficiente y que indujo la producción de anticuerpos que confirieron una protección del 89% como refuerzo contra el coronavirus (leer en https://doi.org/10.1038/s41541-023-00662-6).
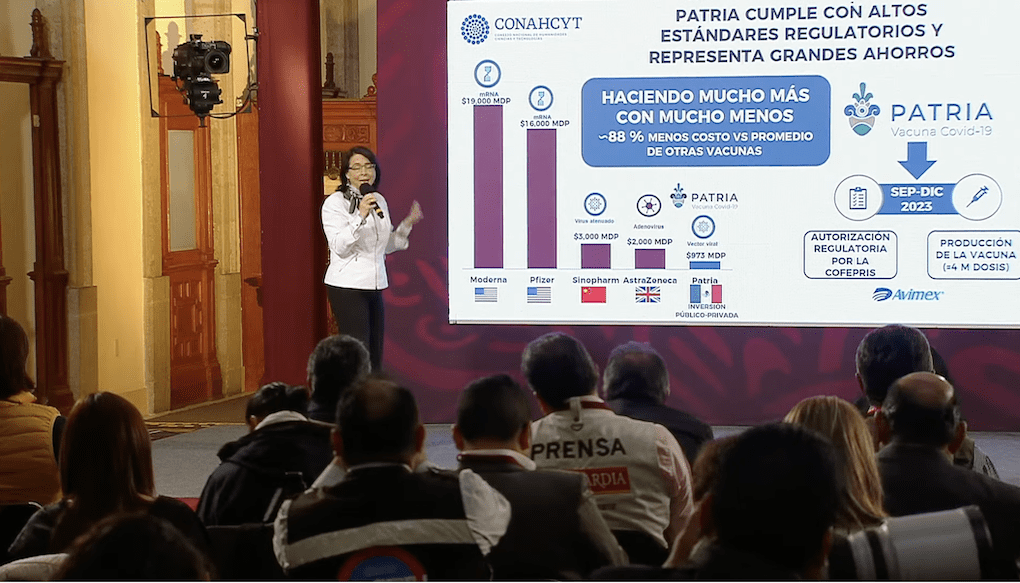
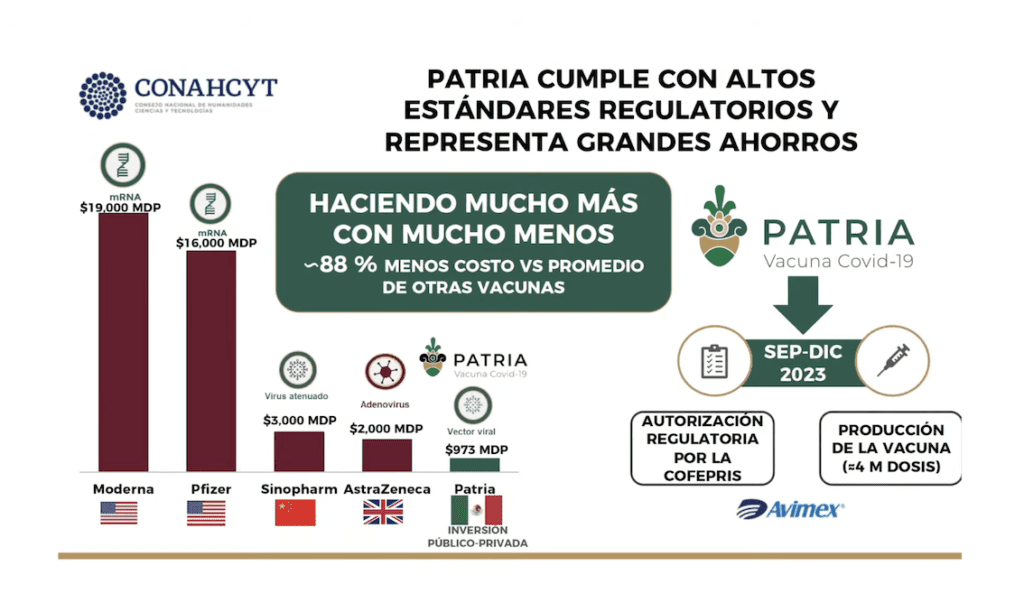
Durante la misma conferencia del 3 de mayo, Álvarez-Buylla, informó que las pruebas de la candidata a vacuna, desarrollada por investigadores estadounidenses, ha tenido un costo de 973 millones de pesos en tres años, desde que inició el proyecto en abril de 2020, hasta lo que va de 2023.
Estos recursos se han entregado como “beneficiaria” a la empresa privada Laboratorio Avi-Mex S.A. de C.V., especializada en la producción de fármacos veterinarios.
A inicios de este año, en información proporcionada a través de la Plataforma Nacional de Transparencia del Instituto Nacional de Transparencia Acceso a la Información Pública y Protección de Datos Personales (INAI), el Conahcyt solo reportó una inversión de 422 millones, que se sumaron a los 15 millones de la Agencia Mexicana de Cooperación Internacional para el Desarrollo (AMEXCID) de la Secretaría de Relaciones Exteriores, lo que arrojaba 438 millones.
La funcionaria comparó la inversión en “Patria” con otras vacunas exitosas entre ellas la vacuna desarrollada por científicos del Instituto Jenner y el Oxford Vaccine Group de la Universidad de Oxford, Reino Unido, que a decir de la funcionaria, fue de dos mil millones de pesos.
La vacuna llamada ChAdOx1 nCoV-19 fue fabricada por la farmacéutica británica-sueca AstraZeneca y estuvo lista un año después de iniciada la pandemia; de hecho, una pequeña parte de esta vacuna fue maquilada por la compañía en México y se ha utilizado en muchos países desde 2021.
En el caso de la candidata a vacuna “Patria”, la inversión ha sido cuantiosa, pero han pasado tres años y aún no se concluyen las pruebas clínicas.
Los resultados del ensayo fase I de “Patria”, publicados el 10 de mayo y realizado en 142 personas, indica que, en 91 de ellas, fue eficiente al inducir la producción de anticuerpos que confirieron una protección del 89% como refuerzo contra el coronavirus.
Fin de la “aprobación de emergencia” de vacunas
Cuando la Organización Mundial de la Salud (OMS) declaró la emergencia sanitaria por la pandemia de COVID-19, el 11 de marzo de 2020, tuvieron que pasar casi tres semanas para que el gobierno mexicano hiciera lo propio.
Desde el inicio de la crisis sanitaria, este sería el primer botón de muestra del menosprecio del gobierno mexicano ante el peligro que representaba el coronavirus.
Sin embargo, cuando la OMS anunció el fin de la emergencia sanitaria, el pasado viernes 5 de mayo, el gobierno mexicano hizo lo propio apenas a los dos días hábiles posteriores, el martes 9 de mayo.
La rapidez para terminar con la alerta sanitaria contrastó con la lentitud o la inexistencia de las medidas para proteger y atender a la población a lo largo de los más de tres años que han transcurrido de la pandemia.
Pero el final de la emergencia no significa el fin de la pandemia, como dijo el propio Tedros Adhanom Ghebreyesus, director general de la OMS, este virus llegó para quedarse, todavía está matando y mutando, y permanece el riesgo de que surjan nuevas variantes que incrementen los casos y las muertes.
Lo cierto es que el coronavirus sigue infectando a miles de personas en más de 100 países de cinco continentes y, de acuerdo con las cifras de la OMS, hasta ahora se han infectado más de 676 millones de personas y han perdido la vida 6 millones 882 mil. Sin embargo, como reconoció el mismo organismo, las cifras más reales se acercan al triple, esto es, alrededor de 21 millones de fallecimientos.
En México, de acuerdo con datos de la Secretaría de Salud, casi 334 mil personas han perdido la vida, pero el gobierno federal, a través del Registro Nacional de Población, tiene información que arroja más de 505 mil fallecimientos que, multiplicados por 3, darían un total de entre 1 millón y millón y medio de muertes en el país a causa del coronavirus.
A partir del anuncio del gobierno federal se dan por terminadas las medidas extraordinarias en materia de salud incluida la aprobación de vacunas y en su lugar se implementará un plan de gestión de largo plazo, que considera a la COVID-19 como una enfermedad endémica y no epidémica.
Esto quiere decir que “Patria” tendrá que pasar las regulaciones nacionales e internacionales mucho más rigurosas y extensas que deben cumplir las vacunas en una situación de normalidad sanitaria, por lo que todavía falta mucho más tiempo y dinero para que la candidata a vacuna se convierta en una vacuna segura y eficaz.
Con el decreto presidencial se terminan todas las acciones extraordinarias en materia de salubridad general por la covid-19 lo que implica el fin de la aprobación por emergencia de las vacunas.