Katalin Karikó nació en 1955, en Szolnok, una pequeña ciudad húngara. Desde niña, a pesar de no haber visto a ninguna investigadora, quiso ser científica. Recuerda que le gustaba observar a su padre carnicero en el trabajo; miraba las vísceras y los corazones de los animales: “Quizás de ahí me vino la vena científica”.
Después de estudiar biología y su doctorado en la Universidad de Szeged y llevar a cabo sus investigaciones postdoctorales en la Academia de Ciencias de Hungría, Kati Karikó se fue a Estados Unidos para hacer otro postdoctorado.
Junto con su esposo y su hija Susan, de solo 2 años, se mudó a Filadelfia para trabajar como estudiante postdoctoral en la Universidad de Temple. Sin embargo, a pesar de ser una excelente investigadora nunca pudo obtener un trabajo estable en ninguna universidad o centro de investigación estadounidense.
Durante décadas se la pasó en puestos temporales como profesora asistente, pero a ella no le importaba, siempre y cuando pudiera continuar con la línea de investigación que le apasionaba: el ácido ribonucleico mensajero o ARNm.
El ARNm es el agente molecular que entra al núcleo de cada célula para leer las instrucciones del ADN y salir con la información para producir todas las proteínas y llevar esa receta a la máquina de producción de proteínas de cada célula, llamada ribosoma; de ahí el nombre.
Con este mensajero, las células tienen las fórmulas para producir todas las proteínas que el organismo humano necesita para todas sus funciones al crecer, desarrollarse, reproducirse, vivir y morir.
“Los descubrimientos de los dos premios Nobel fueron fundamentales para desarrollar vacunas de ARNm eficaces contra la COVID-19 durante la pandemia que comenzó a principios de 2020”: la Asamblea Nobel.

A fines de los años 80, mientras Karikó se la pasaba de laboratorio en laboratorio, esperando que algún científico senior la aceptara y apoyara para conseguir presupuesto para su proyecto, las investigaciones con ARNm empezaron a cobrar interés en el mundo.
En 1989, consiguió un trabajo de profesora asistente con el Dr. Elliot Barnathan, en la Universidad de Pensilvania. Se suponía que recibiría apoyo financiero para sus investigaciones, pero nunca llegó ningún presupuesto. A pesar de ello, permaneció como profesora asistente en la Facultad Perelman de Medicina de esa Universidad, hasta 2011.
Después de varios descubrimientos fundamentales y desarrollos tecnológicos con el ARNm, Katalin Karikó y el estadounidense Drew Weissman recibieron el Premio Nobel de Fisiología o Medicina 2023, por sentar las bases para las vacunas exitosas contra la pandemia de COVID-19, fabricadas por las empresas Pfizer-BioNTech y Moderna.
“Los descubrimientos de los dos premios Nobel fueron fundamentales para desarrollar vacunas de ARNm eficaces contra la COVID-19 durante la pandemia que comenzó a principios de 2020”, señaló la Asamblea Nobel, en conferencia de prensa desde la ciudad de Estocolmo, Suecia.
Pero el camino no fue nada sencillo, principalmente para Karikó, el verdadero cerebro de esta tecnología, que le brindó a la humanidad la mejor herramienta en la lucha contra la pandemia ocasionada por el nuevo coronavirus en el momento en que más se necesitaba y que ha salvado la vida a millones de personas en todo el planeta.
Su madre, fallecida en 2018, siempre confió en ella y aseguraba que algún día ganaría el Nobel. En una llamada telefónica por motivo del anuncio del máximo galardón científico, Karikó recordó: “Mi madre siempre escuchaba el anuncio de los premios Nobel cada año, porque me decía que tal vez lo conseguiría. ¿Sabes?, me reía, porque ni siquiera podía ganar una beca, ni un puesto fijo en la universidad, ni equipo, y le dije a mi mamá: no lo escuches, y ella me dijo: ‘Sí, pero ya sabes, trabajas muy duro’. Y le dije que todos los científicos trabajan muy duro…”.
el camino no fue nada sencillo, principalmente para Karikó, el verdadero cerebro de esta tecnología, que le brindó a la humanidad la mejor herramienta en la lucha contra la pandemia de COVID-19.

En busca de nuevas vacunas
Desde 1895, cuando Louis Pasteur desarrolló la vacuna contra la rabia, se dispuso de vacunas basadas en virus muertos o atenuados como antígenos, mismo método que se mantuvo inalterable hasta mediados de la década de 1980, y que se ha usado contra otros patógenos como la polio, sarampión, tétanos, entre otros.
Las vacunas funcionan como antígeno (por ejemplo, los virus atenuados), que es un agente extraño que, cuando ingresa al organismo humano, es identificado por el sistema inmunitario que responde como un pequeño ejército de moléculas protectoras que generan anticuerpos que neutralizan la amenaza específica. Estos antígenos estimulan y generan la respuesta inmune.
De esta manera, al exponerse al microorganismo real, el sistema inmunitario de la persona vacunada ya está preparado: reconoce y neutraliza al patógeno que produce la infección.
La producción de vacunas con estas técnicas requiere de cultivos celulares a gran escala, lo que la hace costosa y lenta. Por ello, durante mucho tiempo, los investigadores intentaron desarrollar nuevas tecnologías de elaboración de vacunas que no requirieran el uso de cultivos celulares en los laboratorios.
Esto se logró gracias a los avances en la biología molecular de los 80 y 90; así se han desarrollado vacunas basadas en componentes específicos de los virus, en lugar de los virus completos.
Gracias a las contribuciones de Katalin Karikó y otros científicos, ahora se usan partes del código genético viral, que generalmente codifican proteínas que se encuentran en la membrana superficial de los virus, para producir proteínas que sirven de antígenos y que estimulan la formación de anticuerpos protectores ante virus reales. Algunos ejemplos de estas vacunas son las desarrolladas contra el virus de la hepatitis B y el virus del papiloma humano.
También se ha usado una pequeña parte del código genético de los virus patógenos para introducirlos a otros virus inofensivos, y que funcionan como portadores o “vectores”. Este método se utiliza actualmente en la vacuna contra el virus del Ébola.
Cuando se inyectan estas vacunas “vectoriales”, el gen que genera la proteína viral seleccionada se reproduce en las células del huésped, lo que estimula una protección inmunitaria.

El camino del ARNm
Durante la década de 1980, se introdujeron métodos eficientes para producir ARNm sin cultivo celular, como el llamado transcripción in vitro, pero el ARNm resultante era inestable y difícil de administrar, o bien, causaba reacciones inflamatorias.
¿Cómo producir las moléculas de ARN in vitro en un laboratorio de manera estable y cómo introducir el ARNm en las células de un organismo vivo sin desencadenar reacciones inflamatorias? Se planteó Karikó.
Así continuó su largo camino para desarrollar los métodos que le permitirían utilizar esta molécula con fines terapéuticos, sin embargo, en pocas universidades le brindaron la oportunidad de continuar con sus investigaciones, pues no creían en el futuro de su proyecto. Pero siempre encontró aliados.
Logró establecer una colaboración con Elliot Barnathan, en la Universidad de Pensilvania, para mejorar los vasos sanguíneos para la cirugía de derivación cardíaca con el ARNm. Buscaron inducir a las células para producir nuevas proteínas e instruirlas para que fabricaran una proteína llamada receptor de uroquinasa.
No obstante, el proyecto no avanzó como esperaban y Barnathan dejaría la Universidad para trabajar en una empresa biotecnológica. Karikó se quedó sin laboratorio. Solo podía quedarse en la institución si encontraba otro laboratorio que la aceptara; le aconsejaron cambiar de línea de investigación o corría el riesgo de perder su puesto.
Se encontró con Robert Langer, quien investigaba con el ARNm con el fin de tratar pacientes que sufrían accidentes cerebrovasculares. Querían que las células de los vasos sanguíneos produjeran óxido nítrico, una sustancia dilatadora de los vasos sanguíneos, pero los experimentos fracasaron. Langer dejó la Universidad y Karikó, nuevamente, se quedó sin laboratorio y sin recursos para su investigación.
En medio de la incertidumbre, mientras sacaba unas copias fotostáticas, se encontró casualmente con un nuevo investigador para colaborar: el inmunólogo Drew Weissman, quien investigaba las células dendríticas, que tienen funciones importantes en la vigilancia inmunitaria y en la activación de las respuestas inmunes inducidas por vacunas.
Weissman le dijo que quería hacer una vacuna contra el Virus de la Inmunodeficiencia Humana y Karikó le dijo que podía “hacer cualquier cosa con el ARNm”.
Con el método del ARN mensajero ya no son necesarios los virus completos vivos o atenuados, ni los cultivos celulares, sino solo una pequeña parte de una proteína de un virus o incluso un solo gen.

De manera conjunta, analizaron los diferentes tipos de ARN y la forma en que interactúan con el sistema inmunitario humano. Observaron que las células dendríticas reconocen el ARNm transcrito in vitro como una sustancia extraña, lo que conduce su activación, pero en las pruebas con ratones vivos no tenía ese efecto y se producía inflamación y otros trastornos.
Esta inflamación en los roedores obedecía a que el ARNm generaba una reacción inmune exagerada. Los investigadores ignoraban por qué había una respuesta diferenciada entre el ARNm in vitro y el ARNm in vivo. Karikó y Weissman se dieron cuenta de que existían algunas propiedades específicas que hacían esta distinción.
Para descubrir la causa, analizaron las bases del ARN (adenina, uracilo, timina y guanina) y produjeron diferentes variantes de ARNm, cada una con alteraciones en una de estas bases, que luego probaron con las células dendríticas.
Se dieron cuenta de que, al modificar una de las bases o letras en la secuencia genética del ARNm, podía evitarse la inflamación. Con este cambio –llamado técnicamente modificación de nucleósidos–, en lugar de generar la proteína llamada uridina se obtenía pseudouridina, presente en el cuerpo humano en otra molécula llamada ARN de transferencia (ARNt).
Este cambio le permitía al ARNm evadir la respuesta inmune de los ratones vivos, por lo que no hubo más inflamación. Esta modificación fue un descubrimiento clave para el uso terapéutico de la molécula mensajera.
Posteriormente, descubrieron que esta molécula se encuentra en el ARNm natural del ser humano, pero el obtenido con la modificación genética era mucho más potente y se obtenía en mayores cantidades, hasta 10 veces más.
El siguiente paso, después de probar que el ARNm funcionaba, fue analizar la mejor manera de introducir la molécula modificada al interior de las células. Probaron muchos “vehículos de entrega” diferentes, y la mejor opción resultaron ser unas nanopartículas de lípidos (grasas), es decir, tomaron estas partículas y les introdujeron la nueva molécula de ARNm modificada.
Las nanopartículas reaccionaron muy bien ante la presencia del ARNm, ya que, además de funcionar como un buen transporte de la molécula mensajera, fungió como adyuvante, mejorando la respuesta inmunitaria.
Estos hallazgos se publicaron en la revista Immunity, del grupo Cell Press, en agosto de 2005. En el artículo señalan: “Aquí demostramos que una variedad de ARN naturales tenían diferentes capacidades para activar las células inmunes. Los ARN más potentes fueron aquellos que tenían la menor cantidad de nucleósidos modificados; por lo tanto, planteamos la hipótesis de que la modificación de nucleósidos suprime el efecto inmunoestimulante del ARN. En un intento por demostrarlo, se descubrieron varias líneas novedosas de evidencia sobre la activación inmune mediada por ARN”, (leer en DOI: https://doi.org/10.1016/j.immuni.2005.06.008).
Con la molécula de arn mensajero el propio cuerpo produce cualquier proteína como hormonas y fármacos, para generar tratamientos terapéuticos precisos y efectivos.
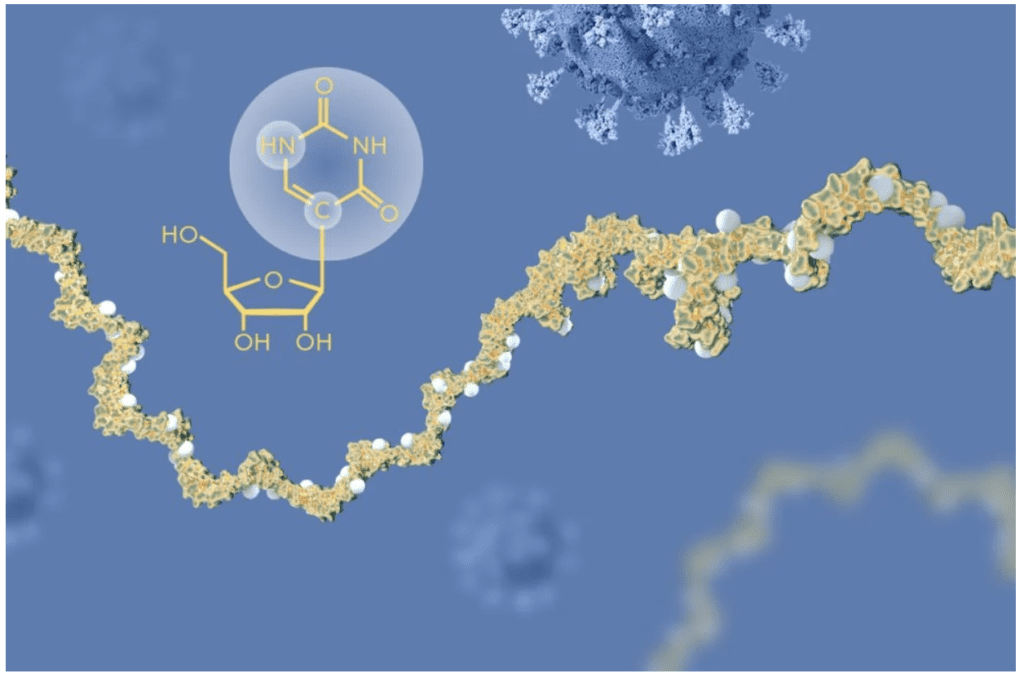
Potencial terapéutico
Para probar tanto a la ARNm como a las nanopartículas, Karikó y Weissman utilizaron esta técnica para que un mono de laboratorio produjera la proteína eritropoyetina, que estimula la producción de glóbulos rojos. Después de diversos experimentos, los recuentos de glóbulos rojos de los animales se elevaron notablemente.
Se dieron cuenta de que se podría aplicar el mismo método en los seres humanos. De esta manera, el propio cuerpo produciría cualquier proteína como hormonas y fármacos, pero, fundamentalmente, para obtener tratamientos terapéuticos precisos y efectivos.
Con este método ya no son necesarios los virus completos vivos o atenuados, ni los cultivos celulares, sino solo una pequeña parte de una proteína de un virus o incluso un solo gen. Se introduce la información del gen del microorganismo en el ARNm y con esa información instruye a las células para producir esa pequeña parte del virus y, eventualmente, protegerlo ante el virus real.
A pesar del éxito, sus hallazgos recibieron poca atención. Solicitaron apoyo para continuar sus investigaciones, pero no tuvieron respuesta: la mayoría de las empresas de capital de riesgo o farmacéuticas –como Merck, que rechazó su petición de 10 mil dólares para financiar su investigación– no estaban interesadas en la tecnología de ARNm: “No será un buen terapéutico”, les contestaban.
Los dos científicos patentaron su tecnología para producir el ARNm modificado, pero al poco tiempo, la Universidad de Pensilvania, poseedora de la mayor parte de los derechos de la patente, cedió la licencia a otra empresa por solo 300 mil dólares.
En los anales de la ciencia quedará para el análisis histórico el papel que desempeñó esta universidad estadounidense ante un avance de tal trascendencia y ante una científica de tal capacidad.
En 2010, un grupo de investigadores de Estados Unidos fundó una empresa cuyo nombre es el acrónimo de ARN modificado en inglés: ModeRNA. Esta empresa compró los derechos de las patentes de Karikó y Weissman, y en poco tiempo recibió fondos privados multimillonarios, entre ellos, 420 millones de dólares de la empresa AstraZeneca, para impulsar sus investigaciones con el ARNm contra enfermedades infecciosas.

La vacuna BioNTech-Pfizer se obtuvo en tiempo récord: 10 meses; en diciembre de 2020 recibió la aprobación de emergencia en Europa, luego en Estados Unidos y después en el resto del mundo.
Mientras tanto, en 2012 la Universidad de Pensilvania obligó a jubilarse del puesto de asistente a Katalin Karikó o, de lo contrario, corría el riesgo de ser despedida. “Me echaron de Penn y me obligaron a jubilarme”, dice Karikó.
Al otro lado del Atlántico, en Alemania, otra pequeña empresa sería fundada por dos científicos de origen turco: Ugur Sahin y Özlem Türeci, que llamarían BioNTech. Esta empresa biotecnológica adquirió varias de las patentes del ARNm de Karikó y Weissman.
Conscientes de la importancia de las contribuciones de Karikó, Ugur Sahin y Özlem Türeci decidieron contratarla como vicepresidenta, en 2013. Su tarea sería impulsar, entre otros, el programa de reemplazo de proteínas para el tratamiento contra el cáncer.
Lo recuerda muy bien: “Hace 10 años, estuve aquí. Cuando finalmente visité Alemania, descubrí que tal vez BioNTech sería el lugar correcto”.
Ya instalada en BioNTech, Karikó continuó su colaboración con sus colegas de Pensilvania: con ellos probó la nueva molécula de ARNm contra el virus del Zika, el VIH, herpes simple y demostraron que funcionaba en experimentos con animales.
“Durante nueve años viajé de EE. UU. a BioNTech, en Alemania. De hecho, hice todos estos experimentos con mis propias manos, tenía 58 años, todavía estaba cultivando plásmidos y alimentando células”.

Defensa contra la COVID-19
Con Karikó al frente de BioNTech, en 2018, se empezó un proyecto conjunto con la farmacéutica Pfizer para desarrollar una vacuna contra la influenza. La probaron con éxito en células in vitro, en animales y estaban preparando todo para iniciar los ensayos clínicos con humanos cuando, a finales de 2019, un nuevo virus aparecería en la ciudad de Wuhan, China.
Ante la irrupción de la pandemia, tanto BioNTech como Pfizer se enfocaron en el nuevo coronavirus que se expandía rápidamente por el mundo y causaba miles de muertes y millones de contagios. De esa manera, iniciaron los experimentos con la información genética del coronavirus, en especial la proteína de pico o espiga “S”.
“Ya estábamos listos para comenzar un ensayo clínico para probar el ARNm. Por lo que cambiar a COVID-19, fue solo una cuestión técnica. Ya estaba preparada”, rememora Karikó.
Desde hacía más de 20 años –en trabajos previos de otros grupos de científicos con otros coronavirus como los del Síndrome Respiratorio Agudo y Severo (SARS), el Síndrome Respiratorio de Oriente Medio (MERS) y el HKU1, parientes cercanos del SARS-CoV-2– sabían que la proteína de pico era el mejor objetivo para obtenerse un antígeno contra la COVID-19.
Esta proteína conforma la membrana exterior y está llena de picos que, vistos al microscopio, le dan la apariencia al virus de llevar una corona (de ahí el nombre). Estos picos son los que usa el coronavirus para adherirse y fusionarse a las células, invadirlas e iniciar el proceso de infección.
Las dos empresas iniciaron sus pruebas con la candidata a vacuna que registraron con el nombre de BNT162b2 (ver en https://clinicaltrials.gov/study/NCT04523571). A la moléculas de ARNm que ya había desarrollado Karikó simplemente le agregaron la información del gen del pico del coronavirus como antígeno. Con esa información la molécula mensajera ARNm montada en la nanopartícula, introdujo la información para que la célula la reprodujera y generara una respuesta inmune protectora.
La vacuna BioNTech-Pfizer se obtuvo en tiempo récord: en julio de 2020 inició los ensayos clínicos y en noviembre de 2020 publicó los resultados del ensayo fase III; en diciembre de 2020 recibiría su aprobación de emergencia en Europa, luego en Estados Unidos y después en el resto del mundo.
Después de la aprobación, la primera persona en recibir la vacuna fue Karikó. Obtuvo una eficacia del 94.5% para prevenir la enfermedad en cuadro moderados y del 100% para prevenir cuadros graves de la infección. Un mes después, Moderna obtendría su vacuna con una eficacia de, al menos, el 94%.
La impresionante flexibilidad y velocidad con la que se pueden desarrollar vacunas de ARNm ha estimulado a las empresas para trabajar con más vacunas para otras enfermedades como el VIH, Ébola, influenza, incluso contra enfermedades autoinmunes.
No se conocen con certeza las ganancias de estas empresas por la venta de las vacunas contra la COVID-19, pero se trata de varios miles de millones de dólares. En la situación de emergencia sanitaria, los países dependientes tecnológicamente como México tuvieron que pagar miles de millones de dólares por las vacunas.
La impresionante flexibilidad y velocidad con la que se pueden desarrollar vacunas de ARNm ha estimulado a las empresas para trabajar con más vacunas para otras enfermedades como el VIH, Ébola, influenza, incluso contra enfermedades autoinmunes.
Karikó recuerda que su hija Susan siempre la vio trabajar duro y se convirtió en bicampeona olímpica de remo. Aprendió de ella la perseverancia: “creo que los primeros 14 años de tu vida, tus genes, tus padres, tus maestros, tus amigos, te moldean a ti, a la persona que serás. También, como mujer y madre, trato de decirles a mis compañeras científicas que no tienen que elegir entre tener una familia, pueden tenerla, no tienen que ayudar demasiado a su hijo, su hijo observará, porque eso es lo que cuenta, el ejemplo que tú presentes”.
Susan es dos veces campeona olímpica y cinco veces campeona mundial de remo y fue incluida en el salón de la fama. “Remaba aquí y allá”, comenta Karikó. “Y siempre me presentaban como la mamá de Susan”.
Pero ahora que Karikó ha recibido el máximo galardón que puede recibir un científico en el planeta: el Premio Nobel, seguramente todo mundo conocerá a Susan como “la hija de Kati Karikó”.
Los descubrimientos de los dos premios Nobel de Medicina 2023 fueron fundamentales para desarrollar vacunas eficaces contra la COVID-19 que han salvado millones de vidas y han evitado enfermedades graves en muchas más; transformaron el campo de las vacunas durante una de las mayores crisis de salud que ha enfrentado la humanidad en el último siglo.



