La Real Academia Sueca de las Ciencias concedió el Premio Nobel de Química 2021 al alemán Benjamin List, del Instituto Max Planck de Investigación del Carbón, y al británico David W.C. MacMillan, de la Universidad de Princeton, “por el desarrollo de la organocatálisis asimétrica”, una ingeniosa herramienta que permite construir moléculas, que ha tenido un gran impacto en la investigación farmacéutica e industrial y ha hecho que la química sea más ecológica y barata.
Thank you for reading this post, don't forget to subscribe!En el año 2000, los dos científicos, de manera independiente, desarrollaron un tercer tipo de catálisis (adicional a la de metales y enzimas) que se basa en pequeñas moléculas orgánicas con la que se pueden construir sustancias que controlan y aceleran las reacciones químicas sin formar parte del producto final, con las que se pueden formar materiales elásticos y duraderos, almacenar energía en baterías o inhibir la progresión de enfermedades, entre muchos otros.
“Los catalizadores de los coches transforman las sustancias tóxicas de los gases de los escapes en moléculas inofensivas”, señaló el comité del Nobel en su comunicado. “Nuestro cuerpo también contiene miles de catalizadores en forma de enzimas, que cincelan las moléculas necesarias para la vida”.
Los catalizadores orgánicos tienen una estructura estable de átomos de carbono a la que se pueden unir grupos químicos más activos como elementos comunes como el oxígeno, nitrógeno, azufre o fósforo, que los hace más respetuosos con el medio ambiente, requieren menos energía y disminuyen su costo.
Gracias a Benjamin List y David MacMillan la organocatálisis se ha desarrollado a una velocidad asombrosa desde el año 2000 y ellos siguen siendo líderes mundiales en este campo. Han demostrado que los catalizadores orgánicos pueden utilizarse para impulsar multitud de reacciones químicas que impactan la vida diaria de la humanidad.
Desde el año 2000, los avances en este campo pueden compararse casi con una fiebre del oro, en la que List y MacMillan mantienen posiciones de liderazgo. Han diseñado multitud de organocatalizadores baratos y estables, que pueden utilizarse para impulsar una enorme variedad de reacciones químicas.

Un poco de historia catalítica
Desde el siglo XIX los científicos han descubierto una gran cantidad de catalizadores para descomponer las moléculas o unirlas. Gracias a ellos, ahora se pueden formar miles de sustancias diferentes que se utilizan en la vida cotidiana, como los productos farmacéuticos, plásticos, perfumes, aromatizantes y saborizantes alimentarios, entre muchos otros. Es tan importante esta área científica y tecnológica que se calcula que el 35% del PIB mundial está relacionado de alguna manera con la catálisis química.
La rápida expansión del uso de los catalizadores orgánicos se debe principalmente a su capacidad para impulsar la catálisis asimétrica. Cuando se construyen moléculas, a menudo se dan situaciones en las que se pueden formar dos moléculas diferentes pero similares que, al igual que nuestras manos, una es la imagen especular o reflejada de la otra. A menudo, los químicos solo quieren una de ellas, sobre todo cuando producen productos farmacéuticos.
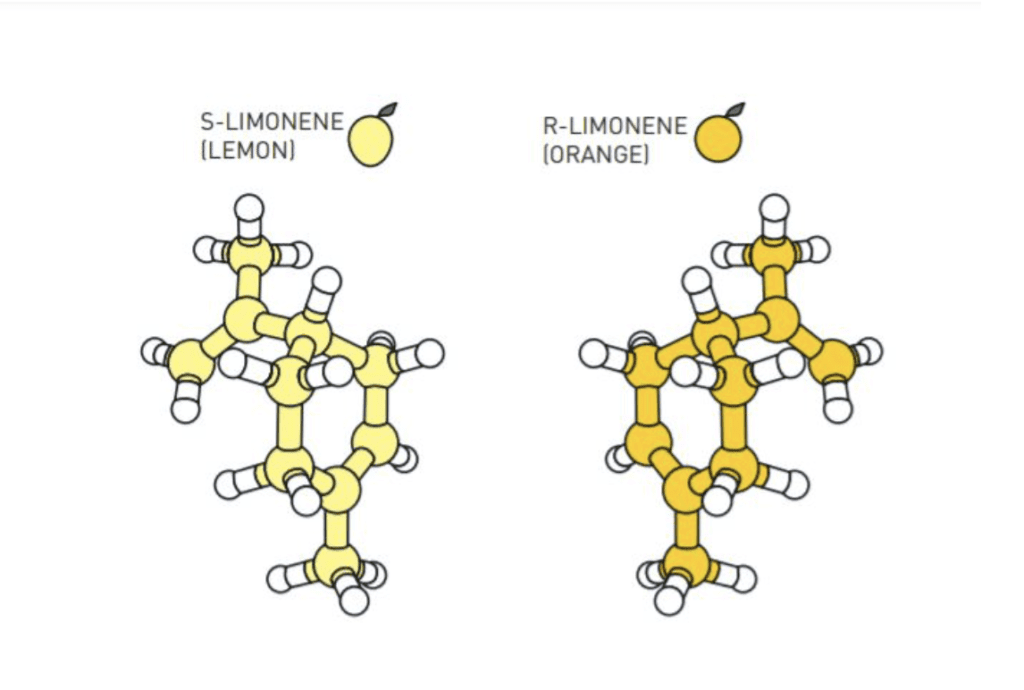
Muchas moléculas existen en estas dos variantes, algo así como la gemela buena y la maldita, o el Dr. Jakyll y Mr. Hyde, que suelen tener efectos completamente diferentes, por ejemplo, una versión de la molécula de limoneno tiene olor a limón, mientras que su imagen especular o reflejada huele a naranja. También, muchos productos farmacéuticos contienen las dos moléculas especulares; una de ellas era activa, mientras que la otra los efectos no deseados. Gracias a la catálisis asimétrica, se puede seleccionar fácilmente la que interesa.
Un ejemplo catastrófico de esto fue el caso de la talidomida un fármaco desarrollado como sedante y calmante de náuseas durante los tres primeros meses de embarazo a fines de los 50 y principios de los 60, en el que una de las moléculas especulares del fármaco –la molécula gemela maldita– causó graves deformidades congénitas en miles de embriones humanos en desarrollo.
Gracias a la organocatálisis, los investigadores pueden ahora fabricar grandes volúmenes de diferentes moléculas asimétricas –utilizando solo la molécula gemela buena– de forma segura y relativamente sencilla.
“Este concepto de catálisis es tan sencillo como ingenioso, y lo cierto es que mucha gente se ha preguntado por qué no se nos ocurrió antes”, comentó Johan Aqvist, presidente del Comité Nobel de Química de la Real Academia Sueca de las Ciencias, durante la conferencia de prensa en la que se anunció el premio.
Sin embargo, hasta el año 2000 los investigadores creyeron que había solo dos tipos de catalizadores disponibles: los metales y las enzimas.
Catálisis de metales y enzimas
Los metales suelen ser excelentes catalizadores porque tienen una capacidad especial para alojar temporalmente electrones o proporcionarlos a otras moléculas durante un proceso químico. Esto ayuda a aflojar los enlaces entre los átomos de una molécula para romperse y formar otros enlaces nuevos. Por ejemplo, se utiliza el platino para obtener derivados del benceno indispensables en la fabricación del nylon, o el titanio para acelerar la obtención de polietileno de alta densidad que se usa para fabricar envases y tapas de botellas plásticas.
Sin embargo, un problema de algunos de estos catalizadores es que son muy sensibles al oxígeno y al agua, por lo que, para que funcionen, necesitan un entorno libre de oxígeno y humedad. Esto es fácil de conseguir en los laboratorios de investigación pero difícil en las industrias a gran escala. Además, muchos catalizadores metálicos son metales pesados, que pueden ser contaminantes y perjudiciales para el medio ambiente.
La otra forma de catálisis conocida está formada por unas proteínas presentes en todos los seres vivos: las enzimas. Todos organismos tienen miles de enzimas diferentes que impulsan las reacciones químicas necesarias para la vida. Muchas son especialistas en catálisis asimétrica y también trabajan codo con codo: cuando una enzima termina una reacción, otra toma el relevo. De este modo, pueden construir moléculas complejas con una precisión asombrosa, como el colesterol, la clorofila o la toxina llamada estricnina, que es una de las moléculas más complejas que conocemos.
Dado que las enzimas son catalizadores eficientes, en los años 90 del siglo pasado, los investigadores trataron de desarrollar nuevas variantes utilizando anticuerpos catalíticos. Normalmente, los anticuerpos se adhieren a los virus o bacterias extrañas en nuestro cuerpo y los inactivan o eliminan, pero los investigadores de Scripps los rediseñaron para que pudieran impulsar reacciones químicas.
Durante su trabajo con los anticuerpos catalíticos, Benjamin List se percató que suelen ser enormes moléculas construidas a partir de cientos de aminoácidos; estas enzimas también contienen metales que ayudan a impulsar los procesos químicos, pero también hay muchas que catalizan reacciones químicas sin la ayuda de los metales. En su lugar, las reacciones son impulsadas por uno o pocos aminoácidos individuales de la enzima.
Benjamin List se preguntó si había aminoácidos u otras moléculas simples que pudieran catalizar una reacción química por sí solas, sin necesidad de formar parte de una enzima. Para responder la pregunta utilizó como catalizador un aminoácido llamado prolina, uno de los aminoácidos que conforman las proteínas de los seres vivos, y observó que podía catalizar una reacción de forma eficiente. Con sus experimentos, no solo demostró que la prolina es un catalizador eficaz, sino también que puede impulsar la catálisis asimétrica.
Comprendió el enorme potencial que acababa de conseguir ya que sumaba un tercer tipo de catalizadores, con la ventaja de que la prolina es una molécula sencilla, barata y respetuosa del medio ambiente. Cuando publicó su descubrimiento en febrero de 2000, List describió la catálisis asimétrica con moléculas orgánicas como un nuevo concepto con muchas oportunidades: “El diseño y el cribado de estos catalizadores es uno de nuestros objetivos futuros”.

Catálisis asimétrica
Por su parte, David MacMillan también trabajaba con el objetivo de mejorar la catálisis asimétrica con metales, campo de mucho interés entre los investigadores, pero observó que rara vez los catalizadores que se desarrollaban se utilizaban en la industria porque eran demasiado difíciles y caros de utilizar. Su conclusión fue que las herramientas químicas que estaba desarrollando necesitaban un replanteamiento para ser más útiles. Dejó atrás los metales y comenzó a diseñar moléculas orgánicas simples que –al igual que los metales– pudieran proporcionar o alojar temporalmente electrones.
MacMillan buscó moléculas orgánicas formadas por elementos sencillos y comunes, como oxígeno, nitrógeno, azufre o fósforo, y seleccionó varias de ellas; probó su capacidad para provocar una reacción de Diels-Alder, que los químicos utilizan para construir anillos de átomos de carbono y, tal y como esperaba, funcionaron de forma brillante. Demostró que algunas de las moléculas orgánicas también son excelentes catalizadores asimétricos.
Cuando David MacMillan se dispuso a publicar sus resultados, se dio cuenta de que el concepto de catálisis que había descubierto podía generalizarse y necesitaba un nombre, por lo que la llamó organocatálisis. La introducción de su artículo dice: “Aquí presentamos una nueva estrategia de organocatálisis que esperamos que sea susceptible de una serie de transformaciones asimétricas”.

Impacto mundial
Desde el año 2000, los avances en este campo pueden compararse casi con una fiebre del oro, en la que List y MacMillan mantienen posiciones de liderazgo. Han diseñado multitud de organocatalizadores baratos y estables, que pueden utilizarse para impulsar una enorme variedad de reacciones químicas.
Pueden realizar varios pasos de un proceso de producción de secuencia ininterrumpida llamado reacción en cascada, que puede reducir considerablemente los residuos contaminantes.
Su impacto ha simplificado la síntesis de distintos compuestos utilizados en diversos procesos industriales con lo cual se han obtenido ahorros sustanciales de energía y se han disminuido los residuos, un ejemplo de ello es el caso de la estricnina una molécula natural, asombrosamente compleja, que se utiliza como pesticida. Cuando se sintetizó por primera vez en laboratorio, en 1952, fueron necesarias 29 reacciones químicas diferentes y sólo el 0.0009% del material inicial formó estricnina. El resto se desperdiciaba. En 2011, con la organocatálisis y una reacción en cascada se obtuvo estricnina en solo 12 pasos, y el proceso de producción fue 7 mil veces más eficiente.
En las empresas farmacéuticas, el método también se utiliza para agilizar la producción de fármacos ya existentes, por ejemplo, la paroxetina, que se utiliza para tratar la ansiedad y la depresión, y el antiviral oseltamivir, que se utiliza para tratar infecciones respiratorias.
Hay miles de ejemplos del uso de la organocatálisis, pero ¿por qué no se le ocurrió antes a nadie este concepto sencillo, ecológico y barato de la catálisis asimétrica? Esta pregunta tiene muchas respuestas. Una de ellas es que las ideas sencillas suelen ser las más difíciles de imaginar. Nuestra visión está oscurecida por fuertes prejuicios sobre cómo debería funcionar el mundo, como la idea de que solo los metales o las enzimas pueden impulsar las reacciones químicas.
Benjamin List y David MacMillan lograron superar estas ideas preconcebidas para encontrar una solución ingeniosa a un problema con el que los químicos habían luchado durante décadas y que resultó en grandes beneficios para la humanidad.


